La vacuna china de Sinopharm: toda la información que conocemos sobre ella
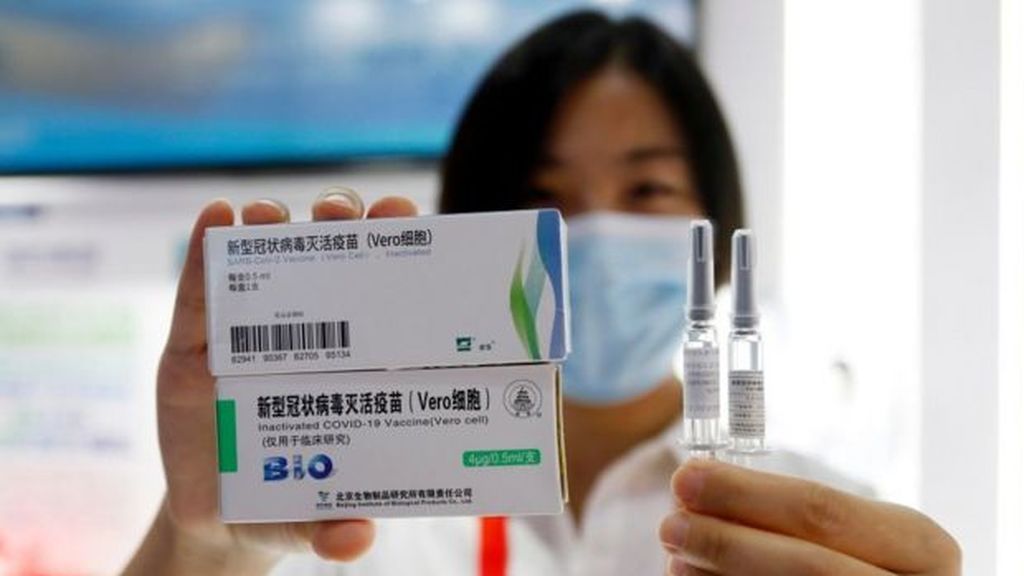
Requiere de dos dosis que deben aplicarse con 21 días de diferencia
La vacuna puede transportarse y almacenarse entre 2 y 8° C
Hungría, primer país de la UE en dar luz verde a esta vacuna
La vacuna del Grupo Farmacéutico Nacional de China (Sinopharm), desarrollada en colaboración con el Beijing Institute of Biological Products, está aprobada para uso público en general y ya se se usa en varios países para combatir la pandemia de coronavirus. Consiste en una vacuna inactivada, lo que significa que porta una versión del SARS-CoV-2 alterada genéticamente para ser incapaz de reproducirse, pero que genera una respuesta inmune en el organismo.
Se trata, pues, de una vacuna muy tradicional, al estilo de las vacunas de la Polio (Salk), de la Hepatitis A o de la Rabia. Requiere de dos dosis que deben aplicarse con 21 días de diferencia. Puede transportarse y almacenarse entre 2 y 8° C y permanecer estable durante 24 meses, lo que presenta una ventaja frente a vacunas como la de Pfizer, que requiere una refrigeración a -70° C, y la Sputnik V, que necesita ser refrigerada a -18° C.
Los ensayos clínicos de Fase I y II, publicados en la revista médica 'The Lancet', demostraron que esta vacuna china es segura y eficaz. Los ensayos de Fase III se realizaron en la Argentina, Perú, Egipto, Jordania, Emiratos Árabes Unidos y Bahréin. En Argentina, las pruebas se iniciaron a finales de agosto de 2020 y fueron realizadas por la Fundación Huésped en los centros Vacunar, con la participación de 3.000 voluntarios.
Una eficacia del 79%
El pasado 30 de diciembre, Sinopharm, farmacéutica china de propiedad estatal, anunció a través de un comunicado de prensa que el primer análisis interino de los resultados del ensayo clínico de la Fase III mostraron que la vacuna alcanza una eficacia del 79,34%. En ese informe se indicaba que la vacuna es segura y que los participantes que recibieron dos dosis produjeron un alto nivel de anticuerpos contra el virus a una tasa del 99,52%.
Los resultados no han sido todavía publicados en una revista científica con referato; esto es, con revisión por pares. El comunicado de prensa, además, proporciona pocos detalles adicionales, no hay información sobre la cantidad de personas evaluadas para alcanzar los resultados o cuáles fueron los eventos secundarios más frecuentemente registrados.
Sinopharm ya había concluido sus ensayos clínicos en Emiratos Árabes Unidos (EAU) el pasado 9 de diciembre, donde los resultados provisionales le otorgaron un 86% de eficacia. En estas pruebas participaron 31.000 voluntarios, aunque tampoco trascendió la existencia de efectos secundarios.
Aprobada en 13 países
El pasado 30 de diciembre, la Administración Nacional de Productos Médicos de China aprobó la vacuna para su uso de emergencia. También ha sido autorizada en Emiratos Árabes Unidos, Bahrein, Egipto, Jordania, Camboya, Irak, Morocco, Serbia, Pakistán, Seychelles y Hungría, el primer país de la Unión Europea en dar luz verde a la vacuna.
En América Latina, el Gobierno de Perú anunció que firmó un acuerdo de compra y una carta de compromiso con Sinopharm para acceder a 30 millones de dosis. El 7 de febrero último llegaron a Perú las primeras 300.000 dosis de la vacuna china y comenzó la campaña de vacunación para el personal de salud.
La de Sinopharm no es la única vacuna que produce un laboratorio chino. También desarrollaron CoronaVac, de Sinovac Biotech y la vacuna llamada Ad5-nCoV o Convidecia, de la compañía Cansino Biologics junto con el Instituto de Biotecnología de Pekín.
Eficaz contra la variante de Sudáfrica
Doce muestras de suero tomadas cada una de receptores de dos vacunas desarrolladas por una subsidiaria de Sinopharm y una unidad de Productos Biológicos Chongqing Zhifei retuvieron la actividad neutralizante contra la variante sudafricana, según 'Reuters'.
Sin embargo, la actividad de las muestras contra la variante fue más débil que contra el virus original y otra variante que se está extendiendo actualmente a nivel mundial. Así, los investigadores han declarado que "la reducción de la actividad debe tenerse en cuenta por su impacto en la eficacia clínica de estas vacunas".
