Realizan el primer análisis a nivel molecular del mundo de la proteína de espícula de ómicron
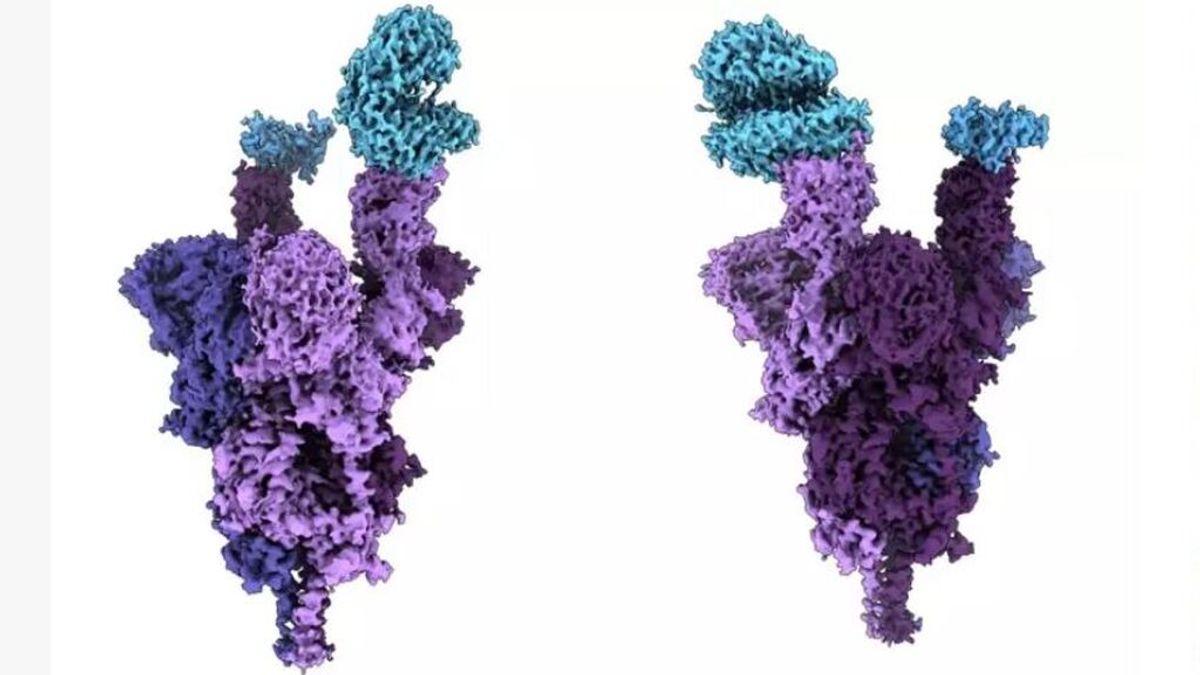
Entender la estructura molecular de la proteína espícula permitirá desarrollar tratamientos más eficaces
El análisis revela cómo se adhiere la variante ómicron a las células humanas y cómo las infecta
Ómicron posee una mayor afinidad de unión que el virus original y una mayor evasión de anticuerpos
El primer análisis estructural a nivel molecular del mundo de la proteína espícula de la variante ómicron del virus del covid-19 se ha llevado a cabo por investigadores de la Facultad de Medicina de la Universidad de Columbia Británica (Canadá). El análisis, publicado en la revista científica 'Science' y realizado con una resolución casi atómica mediante criomicroscopía electrónica, revela cómo se adhiere la variante ómicron a las células humanas y cómo las infecta.
"Entender la estructura molecular de la proteína viral de la espícula es importante, ya que nos permitirá desarrollar tratamientos más eficaces contra ómicron y las variantes relacionadas en el futuro. Al analizar los mecanismos por los que el virus infecta las células humanas, podemos desarrollar mejores tratamientos que interrumpan ese proceso y neutralicen el virus", explica el autor principal de la investigación, Sriram Subramaniam.
MÁS
La proteína 'spike' permite que el SARS-CoV-2 entre en las células humanas
La proteína de espícula del virus, también conocida como 'spike', situada en el exterior del coronavirus, permite que el SARS-CoV-2 entre en las células humanas. La variante ómicron presenta un número sin precedentes de 37 mutaciones en su proteína de espícula, entre tres y cinco veces más que las variantes anteriores.
El análisis estructural reveló que varias mutaciones (R493, S496 y R498) crean nuevos puentes salinos y enlaces de hidrógeno entre la proteína pico y el receptor celular humano conocido como ACE2. Los investigadores concluyeron que estos nuevos enlaces parecen aumentar la afinidad de unión (la fuerza con la que el virus se adhiere a las células humanas), mientras que otras mutaciones (K417N) disminuyen la fuerza de este enlace.
"En general, los resultados muestran que ómicron tiene una mayor afinidad de unión que el virus original, con niveles más comparables a los que vemos con la variante delta. Es notable que la variante ómicron haya evolucionado para conservar su capacidad de unirse a las células humanas a pesar de las extensas mutaciones", ha comentado Subramaniam.
La vacunación sigue siendo la mejor defensa
Los investigadores llevaron a cabo otros experimentos que demostraron que la proteína de espiga de ómicron presenta una mayor evasión de anticuerpos. En contraste con las variantes anteriores, ómicron mostró una evasión medible de los seis anticuerpos monoclonales probados, con un escape completo de cinco. La variante también mostró una mayor evasión de los anticuerpos recogidos de individuos vacunados y de pacientes de covid-19 no vacunados.
"Ómicron fue menos evasivo de la inmunidad creada por las vacunas, en comparación con la inmunidad de la infección natural en pacientes no vacunados. Esto sugiere que la vacunación sigue siendo nuestra mejor defensa", afirma Subramaniam.
Basándose en el aumento observado de la afinidad de unión y la evasión de los anticuerpos, los investigadores dicen que las mutaciones de la proteína de la espiga son probablemente factores que contribuyen a la mayor transmisibilidad de ómicron.

