Unos 'mini pulmones' artificiales permiten observar cómo el coronavirus infecta las células humanas
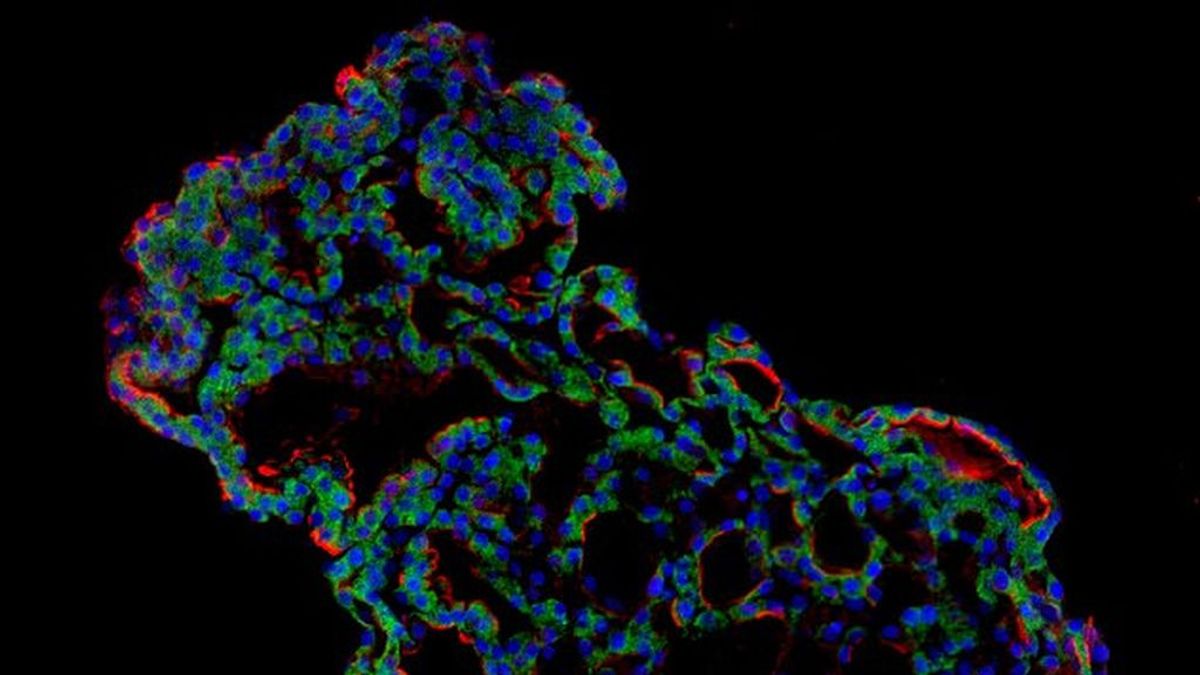
Los modelos tridimensionales se cultivaron a partir de células madre
Replican los sacos de aire que absorben el oxígeno que respiramos
Permitirán probar medicamentos potenciales y comprender mejor la covid19
Unos diminutos pulmones artificiales cultivados en un laboratorio a partir de células madre adultas han permitido a los científicos observar cómo el SARS-CoV-2, lo que supone un "gran avance" en el estudio del comportamiento del coronavirus.
Investigadores de la Universidad de Duke y la Universidad de Cambridge han creado pulmones artificiales en dos estudios independientes y separados para examinar la propagación de covid-19. Estos modelos de "pulmón vivo" replican los diminutos sacos de aire que absorben el oxígeno que respiramos, conocido por ser el lugar donde se produce el daño pulmonar más grave causado por el virus mortal.
MÁS
Tener acceso a los modelos para probar la propagación de SARS-CoV-2, el virus responsable de covid-19, permitirá a los investigadores probar medicamentos potenciales y comprender mejor por qué algunas personas padecen la enfermedad peor que otras.
En ambos estudios, los modelos tridimensionales de pulmones minúsculos se cultivaron a partir de células madre que reparan las partes más profundas de los pulmones cuando ataca el SARS-CoV-2, conocidas como células alveolares.
Los alvéolos, principales tejidos diana del SARS-CoV-2
Los principales tejidos diana del coronavirus, especialmente en pacientes que desarrollan neumonía, parecen ser los alvéolos, según el equipo de Cambridge. Así, extrajeron las células de los alvéolos del tejido donado y las reprogramaron a su etapa anterior de 'células madre' y las obligaron a crecer hasta convertirse en estructuras 3D de tipo alveolar autoprganizadas que imitan el comportamiento del tejido pulmonar clave.
El doctor Joo-Hyeon Lee, coautor principal del artículo de Cambridge, dijo que todavía sabemos sorprendentemente poco sobre cómo el SARS-CoV-2 infecta los pulmones y causa enfermedades. "Nuestro enfoque nos ha permitido desarrollar modelos 3D de tejido pulmonar clave, en cierto sentido," mini pulmones ", en el laboratorio y estudiar lo que sucede cuando se infectan.
Los investigadores de Duke adoptaron un enfoque similar. El equipo, dirigido por el biólogo de células de Duke Purushothama Rao Tata, dice que su modelo permitirá que se realicen cientos de experimentos simultáneamente para detectar nuevos candidatos a fármacos. "Este es un sistema modelo versátil que nos permite estudiar no solo el SARS-CoV-2, sino también cualquier virus respiratorio que se dirija a estas células, incluida la influenza", dijo Tata.
Ambos equipos infectaron modelos con una cepa de SARS-CoV-2 para comprender mejor cómo se propaga el virus y qué sucede en las células pulmonares en respuesta a la enfermedad. El equipo de Cambridge trabajó con investigadores de Corea del Sur para tomar una muestra del virus de un paciente que se infectó en enero después de viajar a Wuhan.
Utilizando una combinación de imágenes de fluorescencia y análisis genético de células individuales, pudieron estudiar cómo respondían las células al virus. Cuando los modelos 3D se expusieron al SARS-CoV-2, el virus comenzó a replicarse rápidamente, alcanzando la infección celular completa solo seis horas después de la infección.
La replicación permite que el virus se propague por todo el cuerpo, infectando otras células y tejidos, explicó el equipo de investigación de Cambridge. Casi al mismo tiempo, las células comenzaron a producir interferones, proteínas que actúan como señales de advertencia para las células vecinas, indicándoles que activen sus defensas. Después de 48 horas, los interferones desencadenaron la respuesta inmune innata, su primera línea de defensa, y las células comenzaron a luchar contra la infección.
Sesenta horas después de la infección, un subconjunto de células alveolares comenzó a desintegrarse, provocando la muerte celular y daño al tejido pulmonar. Aunque los investigadores observaron cambios en las células pulmonares dentro de los tres días posteriores a la infección, los síntomas clínicos de COVID-19 rara vez ocurren tan rápido y, a veces, pueden tardar más de diez días en aparecer.
El equipo dice que hay varias razones posibles para esto. Pueden pasar varios días desde que el virus se infiltra por primera vez en el tracto respiratorio superior hasta que llega a los alvéolos. También puede requerir que se infecte una proporción sustancial de células alveolares antes de que un paciente muestre síntomas, explicó el coautor, el Dr. Young Seok Ju del Instituto Avanzado de Ciencia y Tecnología de Corea.
Se abren múltiples posibilidades terapéuticas
El doctor Young dijo que también podría requerir más interacciones con las células inmunes que provoquen inflamación antes de que los síntomas sean visibles. "Podemos abordar muchas preguntas clave sin respuesta, como comprender la susceptibilidad genética al SARS-CoV-2, evaluar la infectividad relativa de los mutantes virales y revelar los procesos de daño del virus en las células alveolares humanas", dijo.
"Lo más importante es que brinda la oportunidad de desarrollar y seleccionar agentes terapéuticos potenciales contra la infección por SARS-CoV-2. Esperamos utilizar nuestra técnica para hacer crecer estos modelos 3D a partir de células de pacientes que son particularmente vulnerables a las infecciones, como los ancianos o las personas con pulmones enfermos, y descubrir qué sucede con sus tejidos", añadió el doctor Lee.
El equipo de Duke utilizará su modelo pulmonar en 3D junto con otras técnicas, como cambiar cualquier nucleótido del código genético del virus Covid-19 a voluntad. Pudieron adaptarlo para producir una 'versión brillante' del virus para que revelara exactamente dónde fue en el modelo de mini pulmón.
Al igual que los investigadores de Cambridge, el equipo de Duke descubrió que cuando se infectaban con el virus, se demostró que los organoides lanzaban una respuesta inflamatoria mediada por interferones. Los investigadores también han sido testigos de la tormenta de citocinas de moléculas inmunes que los pulmones lanzan en respuesta al virus.
"Se pensaba que la tormenta de citocinas se debía a la gran afluencia de células inmunitarias, pero podemos ver que también ocurre en las propias células madre pulmonares", dijo Tata. Los investigadores de Duke también compararon los patrones de actividad genética entre los mini pulmones y las muestras de seis pacientes con COVID-19 grave.
"Solo hemos podido ver esto en autopsias hasta ahora", dijo Tata. "Ahora tenemos una manera de descubrir cómo energizar las células para luchar contra este virus mortal". Ralph Baric, coautor del artículo de Duke, dijo que usaría los mini pulmones para comprender mejor una nueva cepa de SARS-CoV-2 llamada D614G que se ha convertido en la versión dominante del virus.
